PF Moduł 8: Różnice pomiędzy wersjami
Z Studia Informatyczne
Przejdź do nawigacjiPrzejdź do wyszukiwania
Nie podano opisu zmian |
Nie podano opisu zmian |
||
| Linia 163: | Linia 163: | ||
{| border="0" cellpadding="4" width="100%" | {| border="0" cellpadding="4" width="100%" | ||
|valign="top" width="450px"|[[Grafika:PF_M8_Slajd9.png]] | |valign="top" width="450px"|[[Grafika:PF_M8_Slajd9.png]] | ||
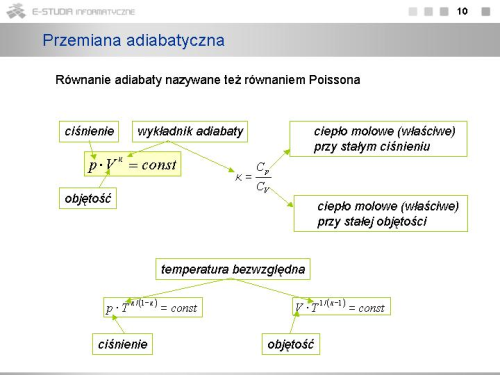
|valign="top"|Przemiana, która zachodzi bez wymiany ciepła z otoczeniem - to '''przemiana adiabatyczna'''. Dla przemiany tej mamy | |||
: <math>\delta Q = 0</math>. | |||
W takim przypadku pierwsza zasada termodynamiki przyjmie postać | |||
: <math>dU=-p \cdot dV</math>, | |||
co oznacza, że w przemianie tej energię wewnętrzną można zmienić jedynie poprzez wykonanie pracy. Zapiszmy to bardziej szczegółowo | |||
: <math>dU=-p \cdot dV</math>, czyli <math>n_M \cdot C_v \cdot dT + {n_M \cdot R \cdot T \over V} \cdot dV = 0</math>. | |||
Można to zapisać nieco inaczej dzieląc obustronnie ostatnie równanie przez <math>n_M \cdot C_v \cdot T</math> | |||
: <math>{dT \over T}+{R \over C_v} \cdot {dV \over V}=0</math>. | |||
Pamiętając z matematyki, że <math>d(lnx)=dx/x</math> oraz, że różniczka sumy równa jest sumie różniczek, możemy to równanie przepisać w postaci | |||
: <math>d(lnT+{R \over C_v} \cdot lnV)=0</math>. | |||
Jeśli różniczka funkcji równa jest zeru, to funkcja równa jest stałej, czyli | |||
: <math>lnT+{R \over C_v} \cdot lnV=const</math>. | |||
Pamiętając, że <math>R/C_v=\kappa -1</math> mamy | |||
: <math>lnT+(\kappa -1) \cdot lnV=const</math>, lub <math>ln(T \cdot V^{\kappa -1})=const</math>. | |||
Jeśli logarytm funkcji równy jest stałej, to i sama funkcja pozostaje stała. Możemy wiec napisać | |||
: <math>T \cdot V^{\kappa -1}=const</math>. | |||
Wykorzystując równanie stanu gazu doskonałego '''pV = RT''' dostajemy | |||
: <math>{p \cdot V \over R} \cdot V^{\kappa -1}=const</math> lub <math>{p \cdot V^\kappa \over R}=const</math>. | |||
Powyższe wzory pozostaną w mocy, jeśli stałą gazową <math>R\,</math> włączymy do stałej po prawej stronie. Otrzymamy wtedy | |||
: <math>p \cdot V^\kappa=const</math>. | |||
Związek ten jest równaniem adiabaty i nosi nazwę '''równania Poissona'''. Postępując podobnie można otrzymać równania określające zależności między innymi parametrami stanu dla przemiany adiabatycznej | |||
: <math>p \cdot T^{\kappa / (1-\kappa)}=const, \ V \cdot T^{1/(\kappa -1)}=const</math>. | |||
Realizacja przemiany adiabatycznej jest trudna, gdyż wymaga idealnej izolacji cieplnej gazu od otoczenia. Warto jednak zauważyć, że gdy sprężanie lub rozprężanie gazu zachodzi bardzo szybko, to nawet mimo nie najlepszej izolacji cieplnej przemiana taka ma charakter bardzo zbliżony do przemiany adiabatycznej. Właściwość tę wykorzystuje się w pracy silników cieplnych. | |||
|} | |||
<hr width="100%"> | |||
{| border="0" cellpadding="4" width="100%" | |||
|valign="top" width="450px"|[[Grafika:PF_M8_Slajd10.png]] | |||
|valign="top"| | |valign="top"| | ||
|} | |} | ||
| Linia 169: | Linia 220: | ||
{| border="0" cellpadding="4" width="100%" | {| border="0" cellpadding="4" width="100%" | ||
|valign="top" width="450px"|[[Grafika: | |valign="top" width="450px"|[[Grafika:PF_M8_Slajd11.png]] | ||
|valign="top"| | |||
|} | |||
<hr width="100%"> | |||
{| border="0" cellpadding="4" width="100%" | |||
|valign="top" width="450px"|[[Grafika:PF_M8_Slajd12.png]] | |||
|valign="top"| | |||
|} | |||
<hr width="100%"> | |||
{| border="0" cellpadding="4" width="100%" | |||
|valign="top" width="450px"|[[Grafika:PF_M8_Slajd13.png]] | |||
|valign="top"| | |||
|} | |||
<hr width="100%"> | |||
{| border="0" cellpadding="4" width="100%" | |||
|valign="top" width="450px"|[[Grafika:PF_M8_Slajd14.png]] | |||
|valign="top"| | |||
|} | |||
<hr width="100%"> | |||
{| border="0" cellpadding="4" width="100%" | |||
|valign="top" width="450px"|[[Grafika:PF_M8_Slajd15.png]] | |||
|valign="top"| | |||
|} | |||
<hr width="100%"> | |||
{| border="0" cellpadding="4" width="100%" | |||
|valign="top" width="450px"|[[Grafika:PF_M8_Slajd16.png]] | |||
|valign="top"| | |||
|} | |||
<hr width="100%"> | |||
{| border="0" cellpadding="4" width="100%" | |||
|valign="top" width="450px"|[[Grafika:PF_M8_Slajd17.png]] | |||
|valign="top"| | |||
|} | |||
<hr width="100%"> | |||
{| border="0" cellpadding="4" width="100%" | |||
|valign="top" width="450px"|[[Grafika:PF_M8_Slajd18.png]] | |||
|valign="top"| | |||
|} | |||
<hr width="100%"> | |||
{| border="0" cellpadding="4" width="100%" | |||
|valign="top" width="450px"|[[Grafika:PF_M8_Slajd19.png]] | |||
|valign="top"| | |||
|} | |||
<hr width="100%"> | |||
{| border="0" cellpadding="4" width="100%" | |||
|valign="top" width="450px"|[[Grafika:PF_M8_Slajd20.png]] | |||
|valign="top"| | |valign="top"| | ||
|} | |} | ||
Wersja z 12:55, 24 sie 2006

|
Wprowadzenie
Omówione są tu ogólne prawa makroskopowe opisujące prawidłowo zjawiska cieplne i pozwalające ilościowo przewidywać skutki różnych procesów. |
|

|

|

|

|
|
|

|

|

|

|