PF Moduł 8: Różnice pomiędzy wersjami
Z Studia Informatyczne
Przejdź do nawigacjiPrzejdź do wyszukiwania
Nie podano opisu zmian |
Nie podano opisu zmian |
||
| Linia 32: | Linia 32: | ||
{| border="0" cellpadding="4" width="100%" | {| border="0" cellpadding="4" width="100%" | ||
|valign="top" width="450px"|[[Grafika:PF_M8_Slajd3.png]] | |valign="top" width="450px"|[[Grafika:PF_M8_Slajd3.png]] | ||
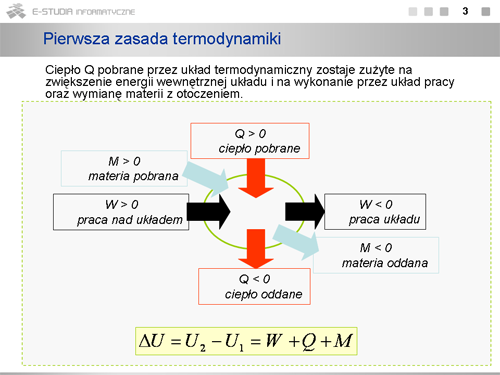
|valign="top"| | |valign="top"|W ten sposób pierwsza zasada termodynamiki wskazuje na trzy różne sposoby zmiany energii wewnętrznej układu: na drodze wykonywania pracy nad układem bądź przez układ oraz poprzez wymianę ciepła lub/i materii pomiędzy układem a otoczeniem. | ||
|} | |} | ||
| Linia 39: | Linia 39: | ||
{| border="0" cellpadding="4" width="100%" | {| border="0" cellpadding="4" width="100%" | ||
|valign="top" width="450px"|[[Grafika:PF_M8_Slajd4.png]] | |valign="top" width="450px"|[[Grafika:PF_M8_Slajd4.png]] | ||
|valign="top"| | |valign="top"|'''W naszych dalszych rozważaniach będziemy omawiać układy nie wymieniające materii z otoczeniem, dla których M=0'''. Zmiana energii wewnętrznej <math>\Delta U</math> układu o stałej masie dokonuje się poprzez wymianę ciepła <math>Q</math>, co zachodzi w warunkach różnicy temperatur pomiędzy układem i otoczeniem, lub/i poprzez pracę <math>W</math> wykonaną nad układem lub przez układ nad otoczeniem. | ||
: <math>\Delta Q=Q+W</math>. | |||
Wprowadzamy tu konwencję, którą będziemy stosować w dalszych rozważaniach dla układów nie wymieniających materii z otoczeniem. | |||
Praca <math>W\,</math> jest dodatnia <math>(W > 0)</math>, jeżeli jest wykonywana przez siły zewnętrzne (otoczenie) nad układem fizycznym. Kiedy układ fizyczny wykonuje pracę nad otoczeniem (kosztem swej energii wewnętrznej) praca ta jest ujemna <math>(W < 0)</math>. Podobnie, ciepło jest dodatnie <math>(Q > 0)</math>, jeśli przepływa z otoczenia do układu, a ujemne <math>(Q < 0)</math>, jeśli przepływa z układu do otoczenia. Dla przykładu, kiedy siły zewnętrzne (otoczenie) wykonują pracę sprężając gaz <math>(\Delta V < 0)</math>, to wykonana praca jest dodatnia, kiedy gaz wykonuje pracę nad otoczeniem rozprężając się <math>(\Delta V > 0)</math>, praca jest ujemna. | |||
|} | |} | ||
| Linia 46: | Linia 53: | ||
{| border="0" cellpadding="4" width="100%" | {| border="0" cellpadding="4" width="100%" | ||
|valign="top" width="450px"|[[Grafika:PF_M8_Slajd5.png]] | |valign="top" width="450px"|[[Grafika:PF_M8_Slajd5.png]] | ||
|valign="top"| | |valign="top"|Dla wyznaczenia skończonej pracy wykonanej w procesie kwazistatycznym, odwracalnym, można rozpatrywać przemianę jako ciąg procesów elementarnych, w których zmiany parametrów układu są nieskończenie małe. Dla procesu elementarnego zapiszemy pierwsza zasadę termodynamiki w postaci | ||
: <math>dU=\delta Q + \delta W</math> | |||
'''UWAGA:''' Symbolami <math>\delta Q</math> i <math>\delta W</math> oznaczamy różniczkowe porcje (a nie skończone przyrosty) wymienianego przez układ ciepła i wykonanej pracy przy nieskończenie małych (infinitezymalnych) zmianach parametrów stanu układu. Wynika, to z faktu, ze ciepło i praca nie są funkcjami stanu, bowiem jak zobaczymy, zależą od drogi przejścia pomiędzy stanami. Mówimy, że są '''funkcjami procesu'''. Symbol <math>dU\,</math> oznacza zmianę energii wewnętrznej, która jest funkcją stanu. W przemianie kołowej, kiedy układ powraca do stanu początkowego, jego energia wewnętrzna mieć będzie taką samą wartość jak w stanie początkowym, co zapisujemy w postaci | |||
: <math>\oint dU=0</math> | |||
Nieskończenie mały przyrost, dla którego spełniony jest powyższy warunek nazywamy '''różniczką zupełną'''. Kiedy warunek ten nie jest spełniony, mamy do czynienia z '''wyrażeniem różniczkowym'''. Różniczkami zupełnymi są nieskończenie małe przyrosty funkcji stanu, ale nie są nimi infinitezymalne ilości wymienianego ciepła, lub wykonanej pracy. Bilans ilości ciepła pobranego i oddanego przez układ w przemianie kołowej lub wykonanej przez układ pracy nie musi być równy zeru. | |||
|} | |} | ||
| Linia 53: | Linia 69: | ||
{| border="0" cellpadding="4" width="100%" | {| border="0" cellpadding="4" width="100%" | ||
|valign="top" width="450px"|[[Grafika:PF_M8_Slajd6.png]] | |valign="top" width="450px"|[[Grafika:PF_M8_Slajd6.png]] | ||
|valign="top"| | |valign="top"|'''Przemiana izochoryczna''' to proces, w którym objętość układu pozostaje stała, czyli <math>V=const</math>. W przemianie tej '''nie jest wykonywana praca'''. W oparciu o pierwszą zasadę termodynamiki mamy dla przemiany izochorycznej relację | ||
: <math>\delta Q_v=du</math>, | |||
co oznacza, że w przemianie izochorycznej możemy zmienić energię wewnętrzną układu jedynie na drodze wymiany ciepła. | |||
Pojemność cieplna jednego mola, tzw. ciepło molowe substancji w procesie przebiegającym bez zmiany objętości wyraża się wzorem | |||
: <math>C_v=({\partial U \over \partial T})_v</math>, | |||
gdzie indeks '''v''' przy znaku pochodnej cząstkowej oznacza, że proces zachodzi w stałej objętości. | |||
Energia wewnętrzna danej masy gazu doskonałego zależy jednak wyłącznie od temperatury. Przekonuje nas o tym doświadczenie J.P. Joule'a z rozprężaniem rozrzedzonego gazu do próżni, gdy układ jest w osłonie izolacyjnej uniemożliwiającej wymianę ciepła z otoczeniem. Możemy wiec dla gazu doskonałego napisać, że | |||
: <math>C_v={dU \over dT}</math>. | |||
W dowolnym procesie kwazistatycznym, odwracalnym, niezależnie, która z wielkości jest stała zmiana energii wewnętrznej <math>n_M</math> moli gazu doskonałego jest określona wzorem: | |||
: <math>dU=n_M \cdot C_v \cdot dT</math>. | |||
Bardziej szczegółowe uzasadnienie tego wzoru, w oparciu o analizę doświadczenia Joule'a, można znaleźć w literaturze. Zapamiętajmy, że powyższy wzór, określający zmianę energii wewnętrznej, ma charakter uniwersalny. Mimo że został sformułowany dla przypadku przemiany izochorycznej i występuje w nim ciepło molowe <math>C_v</math>, może być stosowany przy opisie innych przemian gazowych, gdyż energia wewnętrzna jest funkcją stanu. Informacja ta jest bardzo użyteczna przy rozwiązywaniu zadań. | |||
|} | |} | ||
Wersja z 12:16, 23 sie 2006

|
Wprowadzenie
Omówione są tu ogólne prawa makroskopowe opisujące prawidłowo zjawiska cieplne i pozwalające ilościowo przewidywać skutki różnych procesów. |

|

|

|
|