PF Moduł 10: Różnice pomiędzy wersjami
Z Studia Informatyczne
Przejdź do nawigacjiPrzejdź do wyszukiwania
mNie podano opisu zmian |
m Zastępowanie tekstu – „\displaystyle ” na „” |
||
| Linia 28: | Linia 28: | ||
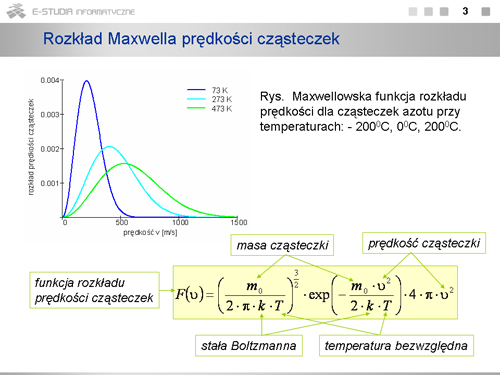
Jeżeli mamy <math>N\,</math> cząsteczek, to liczba <math>dN_v\,</math> cząsteczek o prędkościach w przedziale od <math>v\,</math> do <math>v + dv\,</math> będzie określona wzorem <math>dN_v=N\cdot F(v)\cdot dv</math> , gdzie <math>F(v)\,</math> dane jest wzorem | Jeżeli mamy <math>N\,</math> cząsteczek, to liczba <math>dN_v\,</math> cząsteczek o prędkościach w przedziale od <math>v\,</math> do <math>v + dv\,</math> będzie określona wzorem <math>dN_v=N\cdot F(v)\cdot dv</math> , gdzie <math>F(v)\,</math> dane jest wzorem | ||
<math> | <math>F(v)=\left(\frac{m_0}{2\cdot \pi\cdot k\cdot T} \right)^{3/2}\cdot exp\left(-\frac{m_0\cdot v^2}{2\cdot k\cdot T} \right)\cdot 4\cdot \pi \cdot v^2</math> | ||
|} | |} | ||
| Linia 38: | Linia 38: | ||
|valign="top"|Wyprowadzenie wzoru można znaleźć w literaturze. | |valign="top"|Wyprowadzenie wzoru można znaleźć w literaturze. | ||
<math> | <math>F(v)=\left(\frac{m_0}{2\cdot \pi\cdot k\cdot T} \right)^{3/2}\cdot exp\left(-\frac{m_0\cdot v^2}{2\cdot k\cdot T} \right)\cdot 4\cdot \pi \cdot v^2</math> | ||
Co jest charakterystyczne w tym rozkładzie <math>F(v)\,</math> ? Jest to konieczność wystąpienia maksimum ze względu na iloczyn rosnącej parabolicznie i malejącej wykładniczo zależności od <math>v\,</math> . (Przeanalizuj dokładnie trzy człony wzoru na <math>F(v)\,</math> . Pierwszy, to czynnik normalizacyjny zawierający wyłącznie wartości stałe, drugi - to człon wykładniczy, ale z ujemną wartością w wykładniku, czyli malejący ze wzrostem prędkości i równy jedynce dla <math>v=0,</math> , ostatni - rosnący paraboliczne ze wzrostem prędkości. Rezultat jest zobrazowany na wykresie maxwellowskiej funkcji rozkładu prędkości cząsteczek azotu przy temperaturach: <math>73 K\, (-200^\circ C)\,</math> , <math>273 K\, (0^\circ C)\,</math> , <math>473 K\, (200^\circ C)\,</math>. Gdy temperatura rośnie maksimum krzywej rozkładu przesuwa się w stronę większych prędkości i krzywa ulega spłaszczeniu. Pole pod krzywą równe jest całkowitej liczbie cząsteczek w próbce i pozostaje stałe niezależnie od temperatury. | Co jest charakterystyczne w tym rozkładzie <math>F(v)\,</math> ? Jest to konieczność wystąpienia maksimum ze względu na iloczyn rosnącej parabolicznie i malejącej wykładniczo zależności od <math>v\,</math> . (Przeanalizuj dokładnie trzy człony wzoru na <math>F(v)\,</math> . Pierwszy, to czynnik normalizacyjny zawierający wyłącznie wartości stałe, drugi - to człon wykładniczy, ale z ujemną wartością w wykładniku, czyli malejący ze wzrostem prędkości i równy jedynce dla <math>v=0,</math> , ostatni - rosnący paraboliczne ze wzrostem prędkości. Rezultat jest zobrazowany na wykresie maxwellowskiej funkcji rozkładu prędkości cząsteczek azotu przy temperaturach: <math>73 K\, (-200^\circ C)\,</math> , <math>273 K\, (0^\circ C)\,</math> , <math>473 K\, (200^\circ C)\,</math>. Gdy temperatura rośnie maksimum krzywej rozkładu przesuwa się w stronę większych prędkości i krzywa ulega spłaszczeniu. Pole pod krzywą równe jest całkowitej liczbie cząsteczek w próbce i pozostaje stałe niezależnie od temperatury. | ||
| Linia 52: | Linia 52: | ||
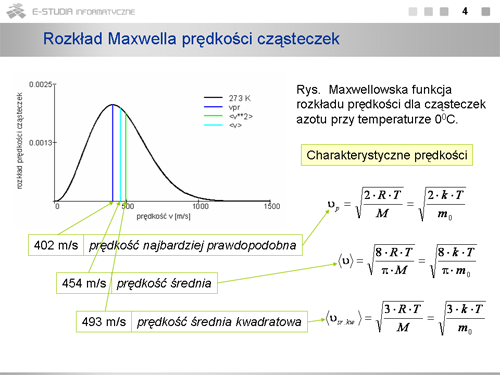
|valign="top"|Dla każdej temperatury można określić prędkość, która występuje najczęściej, czyli najwięcej cząsteczek ma prędkości bliskie tej wartości. Wartość ta odpowiada maksimum rozkładu Maxwella. Prędkość tę nazywamy prędkością najbardziej prawdopodobną, <math>v_p\,</math> . Można ją określić z matematycznego warunku na maksimum funkcji. | |valign="top"|Dla każdej temperatury można określić prędkość, która występuje najczęściej, czyli najwięcej cząsteczek ma prędkości bliskie tej wartości. Wartość ta odpowiada maksimum rozkładu Maxwella. Prędkość tę nazywamy prędkością najbardziej prawdopodobną, <math>v_p\,</math> . Można ją określić z matematycznego warunku na maksimum funkcji. | ||
:<math> | :<math>\frac{dF(v)}{dv}\Big|_{v=v_p}=0</math> | ||
Stąd otrzymuje się <math>v_p=\sqrt{2\cdot k\cdot T/m_0 }</math> , a więc <math>v_p<v_{sr. kw.}</math> jak to wynika z definicji średniej prędkości kwadratowej (teoria kinetyczna). | Stąd otrzymuje się <math>v_p=\sqrt{2\cdot k\cdot T/m_0 }</math> , a więc <math>v_p<v_{sr. kw.}</math> jak to wynika z definicji średniej prędkości kwadratowej (teoria kinetyczna). | ||
| Linia 73: | Linia 73: | ||
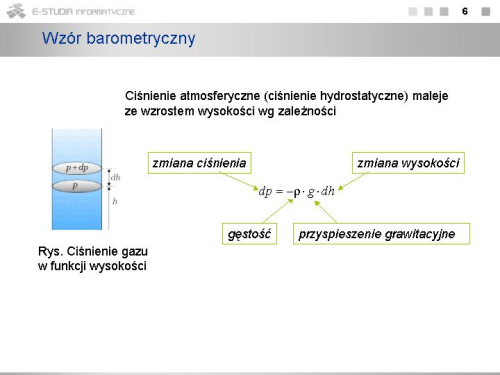
Z dobrym przybliżeniem można potraktować powietrze jako gaz doskonały. Dzieląc obustronnie równanie stanu gazu doskonałego dla jednego mola <math>p\cdot V=R\cdot T</math> przez wartość średniej masy molowej powietrza, określonej z uwzględnieniem procentowej zawartości azotu, tlenu i pozostałych gazów w powietrzu, otrzymujemy | Z dobrym przybliżeniem można potraktować powietrze jako gaz doskonały. Dzieląc obustronnie równanie stanu gazu doskonałego dla jednego mola <math>p\cdot V=R\cdot T</math> przez wartość średniej masy molowej powietrza, określonej z uwzględnieniem procentowej zawartości azotu, tlenu i pozostałych gazów w powietrzu, otrzymujemy | ||
<math>p\cdot \begin{matrix} \underbrace{ (V/M) } \\ {1/{\rho}} \end{matrix}= | <math>p\cdot \begin{matrix} \underbrace{ (V/M) } \\ {1/{\rho}} \end{matrix}=\frac{R\cdot T}{M}</math> , czyli <math>\rho=\frac{M\cdot p}{R\cdot T}</math> | ||
Więc możemy napisać, że | Więc możemy napisać, że | ||
: <math> | : <math>dp=-\frac{M\cdot p\cdot g}{R\cdot T}\cdot dh</math> | ||
Otrzymujemy w ten sposób równanie różniczkowe o rozdzielonych zmiennych | Otrzymujemy w ten sposób równanie różniczkowe o rozdzielonych zmiennych | ||
: <math> | : <math>\frac{dp}{p}=-\frac{M \cdot g}{R\cdot T}\cdot dh</math> | ||
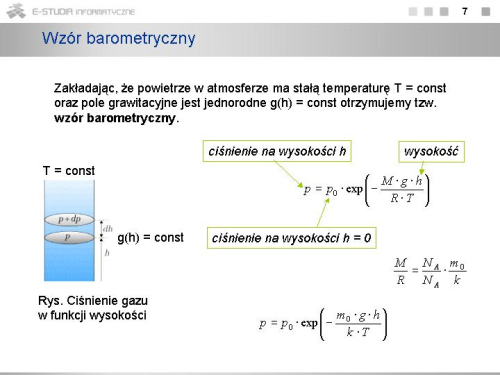
Zakładając, że temperatura atmosfery ma wartość stałą (tzw. atmosfera izotermiczna) i pole grawitacyjne jest jednorodne <math>(g(h) = const)\,</math> możemy łatwo scałkować to równanie otrzymując | Zakładając, że temperatura atmosfery ma wartość stałą (tzw. atmosfera izotermiczna) i pole grawitacyjne jest jednorodne <math>(g(h) = const)\,</math> możemy łatwo scałkować to równanie otrzymując | ||
: <math> | : <math>lnp=-\frac{M \cdot g\cdot h}{R\cdot T}+lnC</math> | ||
gdzie <math>lnC\,</math> to stała całkowania. | gdzie <math>lnC\,</math> to stała całkowania. | ||
| Linia 91: | Linia 91: | ||
Wynika stąd, że | Wynika stąd, że | ||
: <math> | : <math>p=C\cdot exp\left(-\frac{M \cdot g\cdot h}{R\cdot T}\right)</math> | ||
Dla <math>h=0\,</math> ciśnienie równe jest ciśnieniu atmosferycznemu <math>p_0\,</math> na powierzchni Ziemi. Stąd wyznaczamy stałą, <math>C=p_0\,</math> . Ostatecznie otrzymujemy | Dla <math>h=0\,</math> ciśnienie równe jest ciśnieniu atmosferycznemu <math>p_0\,</math> na powierzchni Ziemi. Stąd wyznaczamy stałą, <math>C=p_0\,</math> . Ostatecznie otrzymujemy | ||
: <math> | : <math>p=p_0\cdot exp\left(-\frac{M \cdot g\cdot h}{R\cdot T}\right)</math> | ||
Jest to tzw. '''wzór barometryczny'''. Wynika z niego, że ciśnienie zmienia się z wysokością szybciej dla niższych temperatur oraz dla cięższego gazu, i że zmiana ta ma charakter wykładniczy | Jest to tzw. '''wzór barometryczny'''. Wynika z niego, że ciśnienie zmienia się z wysokością szybciej dla niższych temperatur oraz dla cięższego gazu, i że zmiana ta ma charakter wykładniczy | ||
| Linia 101: | Linia 101: | ||
Wzór barometryczny obowiązuje dla '''atmosfery izotermicznej''', dla której mamy oraz jednorodnego pola grawitacyjnego. Jeżeli warunki te nie są spełnione, należy odpowiednio podstawić zależność funkcyjną temperatury od wysokości oraz zależność <math>g = g(h)\,</math> i rozwiązać otrzymane równanie różniczkowe. | Wzór barometryczny obowiązuje dla '''atmosfery izotermicznej''', dla której mamy oraz jednorodnego pola grawitacyjnego. Jeżeli warunki te nie są spełnione, należy odpowiednio podstawić zależność funkcyjną temperatury od wysokości oraz zależność <math>g = g(h)\,</math> i rozwiązać otrzymane równanie różniczkowe. | ||
Korzystając z faktu, że <math> | Korzystając z faktu, że <math>\frac{M}{R}=\frac{N_A\cdot m_0}{N_A\cdot k}=\frac{m_0}{k}</math> , gdzie <math>m_0\,</math> - średnia masa cząsteczki powietrza, możemy wzór barometryczny przedstawić w postaci | ||
: <math> | : <math>p=p_0\cdot exp\left(-\frac{m_0 \cdot g\cdot h}{k\cdot T}\right)</math> | ||
|} | |} | ||
| Linia 116: | Linia 116: | ||
Przepiszmy w nieco innej formie wzór barometryczny. Zakładając atmosferę izotermiczną, możemy zamienić ciśnienia <math>p\,</math> i <math>p_0\,</math> występujące we wzorze barometrycznym wielkościami <math>n\,</math> i <math>n_0\,</math> , które reprezentują koncentrację cząsteczek, czyli ich liczbę w jednostce objętości na wysokości <math>h\,</math> oraz na powierzchni Ziemi. Wykorzystując to zapiszemy wzór barometryczny w formie | Przepiszmy w nieco innej formie wzór barometryczny. Zakładając atmosferę izotermiczną, możemy zamienić ciśnienia <math>p\,</math> i <math>p_0\,</math> występujące we wzorze barometrycznym wielkościami <math>n\,</math> i <math>n_0\,</math> , które reprezentują koncentrację cząsteczek, czyli ich liczbę w jednostce objętości na wysokości <math>h\,</math> oraz na powierzchni Ziemi. Wykorzystując to zapiszemy wzór barometryczny w formie | ||
: <math> | : <math>n=n_0\cdot exp\left(-\frac{m_0 \cdot g\cdot h}{k\cdot T}\right)</math> | ||
Zwróćmy uwagę, że wyrażenie <math>m_0\cdot g\cdot h\,</math> jest po prostu energią potencjalną <math>E_p\,</math> cząsteczki w polu sił ciężkości (przy założeniu jednorodnego pola grawitacyjnego). Więc również | Zwróćmy uwagę, że wyrażenie <math>m_0\cdot g\cdot h\,</math> jest po prostu energią potencjalną <math>E_p\,</math> cząsteczki w polu sił ciężkości (przy założeniu jednorodnego pola grawitacyjnego). Więc również | ||
: <math> | : <math>n=n_0\cdot exp\left(-\frac{E_p}{k\cdot T}\right)</math> | ||
Ten wzór wyraża zależność koncentracji cząsteczek od ich wysokości lub grawitacyjnej energii potencjalnej. Wynikający z niego rozkład koncentracji nosi nazwę '''rozkładu Boltzmanna''' i odnosi się nie tylko do pola sił przyciągania ziemskiego, ale do dowolnego pola potencjalnego, jeśli tylko cząsteczki poruszają się chaotycznym ruchem cieplnym. | Ten wzór wyraża zależność koncentracji cząsteczek od ich wysokości lub grawitacyjnej energii potencjalnej. Wynikający z niego rozkład koncentracji nosi nazwę '''rozkładu Boltzmanna''' i odnosi się nie tylko do pola sił przyciągania ziemskiego, ale do dowolnego pola potencjalnego, jeśli tylko cząsteczki poruszają się chaotycznym ruchem cieplnym. | ||
| Linia 150: | Linia 150: | ||
Liczba mikrostanów dla danego makrostanu, w którym <math>k\,</math> cząsteczek znajduje się z lewej strony równa jest liczbie kombinacji <math>k\,</math> - elementowych w zbiorze o <math>N\,</math> elementach i wynosi | Liczba mikrostanów dla danego makrostanu, w którym <math>k\,</math> cząsteczek znajduje się z lewej strony równa jest liczbie kombinacji <math>k\,</math> - elementowych w zbiorze o <math>N\,</math> elementach i wynosi | ||
: <math> | : <math>W(N, k)=\frac{N!}{k!(N-k)!}</math> | ||
Jest to właśnie waga statystyczna danego makrostanu. Sumaryczna liczba wszystkich mikrostanów wynosi <math>2^N\,</math>. Prawdopodobieństwo danego makrostanu jest równe stosunkowi jego wagi statystycznej do sumarycznej liczby wszystkich mikrostanów i dla naszego przypadku podane jest w prawej kolumnie tabeli. Prawdopodobieństwo, że dana cząsteczka znajdzie się z prawej lub z lewej strony naczynia jest takie samo, czyli '''prawdopodobieństwa wszystkich mikrostanów są sobie równe'''. Uogólnienie tego stwierdzenia na zdefiniowane w dowolny sposób mikrostany nosi nazwę '''hipotezy ergodycznej'''. | Jest to właśnie waga statystyczna danego makrostanu. Sumaryczna liczba wszystkich mikrostanów wynosi <math>2^N\,</math>. Prawdopodobieństwo danego makrostanu jest równe stosunkowi jego wagi statystycznej do sumarycznej liczby wszystkich mikrostanów i dla naszego przypadku podane jest w prawej kolumnie tabeli. Prawdopodobieństwo, że dana cząsteczka znajdzie się z prawej lub z lewej strony naczynia jest takie samo, czyli '''prawdopodobieństwa wszystkich mikrostanów są sobie równe'''. Uogólnienie tego stwierdzenia na zdefiniowane w dowolny sposób mikrostany nosi nazwę '''hipotezy ergodycznej'''. | ||
| Linia 214: | Linia 214: | ||
<div class="mw-collapsible mw-made=collapsible mw-collapsed"><span class="mw-collapsible-toogle mw-collapsible-toogle-default style="font-variant:small-caps">Rozwiązanie </span><div class="mw-collapsible-content" style="display:none"> | <div class="mw-collapsible mw-made=collapsible mw-collapsed"><span class="mw-collapsible-toogle mw-collapsible-toogle-default style="font-variant:small-caps">Rozwiązanie </span><div class="mw-collapsible-content" style="display:none"> | ||
Układem jest porcja <math>n_M\,</math> moli gazu zawierająca liczbę <math>N\,</math> identycznych, niezależnych cząsteczek (podukładów). Prawdopodobieństwo stanu <math>W\,</math> równe jest iloczynowi prawdopodobieństw stanów podukładów <math> | Układem jest porcja <math>n_M\,</math> moli gazu zawierająca liczbę <math>N\,</math> identycznych, niezależnych cząsteczek (podukładów). Prawdopodobieństwo stanu <math>W\,</math> równe jest iloczynowi prawdopodobieństw stanów podukładów <math>w_i(1,2,...,N)\,</math>. | ||
Dla pojedynczej cząsteczki prawdopodobieństwo jej przebycia w objętości <math>V\,</math> jest proporcjonalne do <math>V\,</math>, a dla <math>N\,</math> cząsteczek do <math>V^{n}\,</math>. Więc <math> | Dla pojedynczej cząsteczki prawdopodobieństwo jej przebycia w objętości <math>V\,</math> jest proporcjonalne do <math>V\,</math>, a dla <math>N\,</math> cząsteczek do <math>V^{n}\,</math>. Więc <math>w_i=A\cdot V</math> | ||
:<math> | :<math>W=w_{i}^{N}=(A\cdot V)^N</math> A jest stałą proporcjonalności. Z definicji entropii, będzie: | ||
:<math> | :<math>S=k\cdot N(lnA+lnV)</math> | ||
Liczba cząsteczek i ich temperatura nie zmienia się. Zwiększa się objętość porcji gazu od <math>V_0\,</math> do <math>V_k\,</math> i zwiększa się entropia (nieuporządkowanie) układu | Liczba cząsteczek i ich temperatura nie zmienia się. Zwiększa się objętość porcji gazu od <math>V_0\,</math> do <math>V_k\,</math> i zwiększa się entropia (nieuporządkowanie) układu | ||
<math> | <math>\Delta S=S_k-S_0= k\cdot N(lnA+lnV_k)- k\cdot N(lnA+lnV_0)= k\cdot N\cdot ln\frac{V_k}{V_0}=n_M\cdot R\cdot ln\frac{V_k}{V_0}</math> | ||
</div></div> | </div></div> | ||
| Linia 250: | Linia 250: | ||
<div class="mw-collapsible mw-made=collapsible mw-collapsed"><span class="mw-collapsible-toogle mw-collapsible-toogle-default style="font-variant:small-caps">Odpowiedź </span><div class="mw-collapsible-content" style="display:none"> | <div class="mw-collapsible mw-made=collapsible mw-collapsed"><span class="mw-collapsible-toogle mw-collapsible-toogle-default style="font-variant:small-caps">Odpowiedź </span><div class="mw-collapsible-content" style="display:none"> | ||
<math> | <math>\Delta S=R\cdot \left(n_{M1}\cdot ln\frac{V_1+V_2}{V_1}+ n_{M2}\cdot ln\frac{V_1+V_2}{V_1} \right)</math> , entropia układu wzrośnie, bo jest to proces nieodwracalny, entropia układu wzrośnie, bo wzrośnie nieuporządkowanie elementów układu. | ||
</div></div> | </div></div> | ||
Wersja z 08:56, 28 sie 2023
Wykład
Materiały do ćwiczeń
Zadanie 10.3
Oblicz zmianę entropii moli gazu doskonałego w procesie izotermicznego rozprężania od objętości do objętości
Rozwiązanie
Zadanie 10.4
Przy jakiej temperaturze średnia prędkość kwadratowa cząsteczek dwutlenku węgla będzie równa średniej prędkości kwadratowej cząsteczek azotu w temperaturze ?
Odpowiedź
Zadanie 10.5
Izolowany układ dwóch zbiorników. Zbiornik o objętości zawierał moli gazu o temperaturze . Zbiornik o objętości zawierał moli również o temperaturze , Oblicz zmianę entropii tych gazów po połączeniu zbiorników i powstaniu mieszaniny.
Odpowiedź
Słowniczek
| wzór barometryczny | podaje zależność ciśnienia atmosferycznego od wysokości nad powierzchnią Ziemi |
| rozkład Maxwella prędkości cząsteczek | rozkład wartości prędkości chaotycznego ruchu cząsteczek gazu doskonałego dla zadanej temperatury i masy cząsteczek |
| rozkład Boltzmanna | rozkład koncentracji cząsteczek w funkcji ich wysokości lub energii potencjalnej. Odnosi się nie tylko do pola sił przyciągania ziemskiego, ale do dowolnego pola potencjalnego, jeśli tylko cząsteczki poruszają się chaotycznym ruchem cieplnym. |
| mikrostan | stan układu w którym opisane są stany wszystkich jego elementów |
| hipoteza ergodyczna | Prawdopodobieństwa wszystkich mikrostanów są jednakowe |
| makrostan | stan układu opisany za pomocą wielkości odnoszących się do całości układu |
| prawdopodobieństwo termodynamiczne (waga statystyczna) | odnosi się do makrostanu układu: liczba mikroskoopowych sposobów realizacji danego makrostanu (liczba mikrostanów odpowiadająca danemu makrostanowi) |
| entropia | definicja statystyczna: wielkość proporcjonalna do logarytmu prawdopodobieństwa termodynamicznego stanu układu |
| fluktuacje | losowe odchylenia danej wielkości od wartości średniej |
| prawo wzrostu entropii | entropia układu izolowanego nie może maleć, w procesach nieodwracalnych entropia układu rośnie |