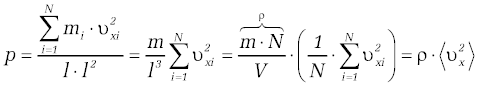PF Moduł 9: Różnice pomiędzy wersjami
Z Studia Informatyczne
Przejdź do nawigacjiPrzejdź do wyszukiwania
Nie podano opisu zmian |
Nie podano opisu zmian |
||
| Linia 80: | Linia 80: | ||
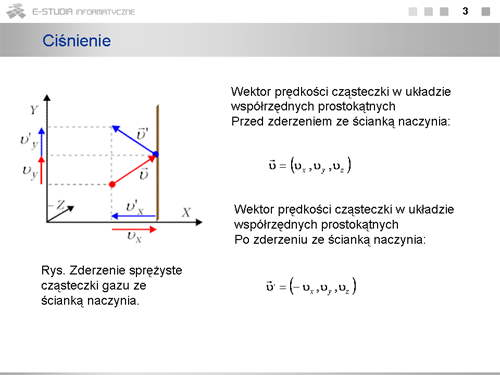
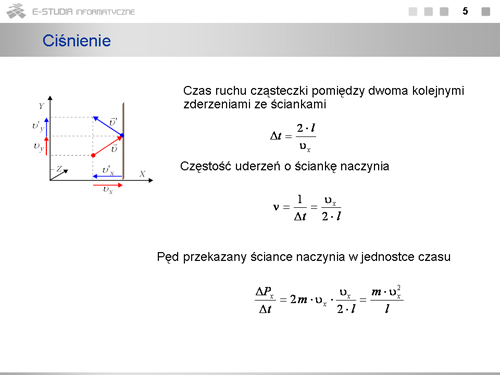
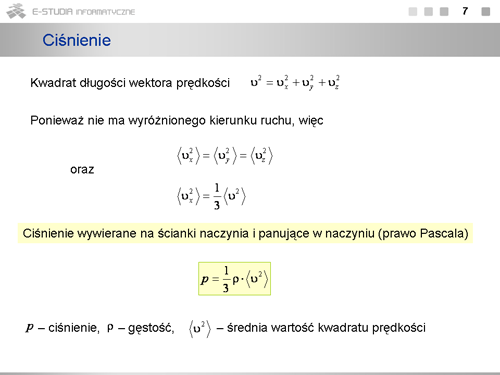
W naszych rozważaniach nie uwzględnialiśmy zderzeń pomiędzy cząsteczkami. Zwróćmy jednak uwagę, że w zderzeniach sprężystych jest zachowany pęd oraz energia kinetyczna, a więc przy dużej liczbie zderzających się cząsteczek zderzenia te nie będą wpływać na wartość średnią pędu przekazywanego ściankom naczynia. Wybraliśmy także regularny (sześcienny) kształt naczynia. W warunkach równowagi ciśnienie wywierane na wszystkie ścianki o dowolnym kształcie a także wewnątrz naczynia jest jednakowe, o czym wiemy z prawa Pascala. Rozważania nasze mają, więc ogólny charakter. | W naszych rozważaniach nie uwzględnialiśmy zderzeń pomiędzy cząsteczkami. Zwróćmy jednak uwagę, że w zderzeniach sprężystych jest zachowany pęd oraz energia kinetyczna, a więc przy dużej liczbie zderzających się cząsteczek zderzenia te nie będą wpływać na wartość średnią pędu przekazywanego ściankom naczynia. Wybraliśmy także regularny (sześcienny) kształt naczynia. W warunkach równowagi ciśnienie wywierane na wszystkie ścianki o dowolnym kształcie a także wewnątrz naczynia jest jednakowe, o czym wiemy z prawa Pascala. Rozważania nasze mają, więc ogólny charakter. | ||
|} | |||
<hr width="100%"> | |||
{| border="0" cellpadding="4" width="100%" | |||
|width="450px" valign="top"|[[Grafika:PF_M9_Slajd8.png]] | |||
|valign="top"|Dla znalezienia związku pomiędzy makroskopową i mikroskopową interpretacją temperatury pomnóżmy lewą i prawą stronę równania opisującego ciśnienie gazu przez objętość naczynia <math>V\,</math> i porównajmy to wyrażenie z równaniem stanu gazu doskonałego | |||
<math>p\cdot V=\frac{1}{3}\cdot\rho\left\langle v^2\right\rangle\cdot V=\frac{1}{3}\cdot \begin{matrix} n_M\cdot M \\ \overbrace{ \rho\cdot V} \end{matrix}\cdot \left\langle v^2\right\rangle </math> | |||